

时间:2022-11-24 16:54:49
本文对现有的循证医学证据进行检索和梳理,阐述人血清白蛋白在危重症患者救治过程中发挥多项非胶体功能的机制及治疗作用,并对其在救治危重症患者中的价值进行探讨,为此后人血清白蛋白非胶体功能的应用提供部分参考···
人血白蛋白是临床常用的胶体液,在临床上多用于改善危重症患者血管内胶体渗透压,其物质结合和转运、抗氧化、抗炎、免疫调节、保护内皮细胞等多种非胶体特性与作用常常被忽视。本文对现有的循证医学证据进行检索和梳理,阐述人血清白蛋白在危重症患者救治过程中发挥多项非胶体功能的机制及治疗作用,并对其在救治危重症患者中的价值进行探讨,为此后人血清白蛋白非胶体功能的应用提供部分参考。
一、物质结合与转运
HSA的多种物质结合和转运功能依赖于其特殊的分子结构。
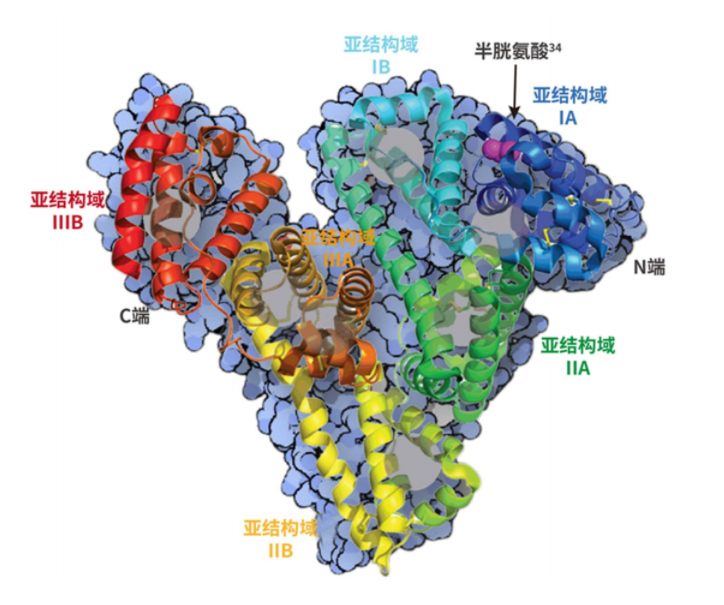
其一级结构为包含 585 个氨基酸残基的单一多肽链,其中的大量的半胱氨酸残基形成二硫键(-S-S)用于维持二级结构的稳定,在 34 位留下一个游离的 Cys34 残基,构成血浆中的主要巯基库。
在二级结构的基础上进一步盘绕和折叠构成了 3 个同源亚结构域(亚结构域 I、II 和 III),组成心形的三级结构,该三级结构包含疏水性内部和亲水性外部。
这种结构稳定而灵活,其结合位点允许与各种配体相互作用,可逆性结合包括阳离子、胆红素、激素、脂肪酸和各种聚合物、药物等。
l 胆红素和胆汁酸
胆红素为血红蛋白分解后产生的有毒不溶性代谢物,可以被HSA结合,并单独运输到肝细胞与葡萄糖醛酸结合,通过胆汁-肠道系统排出体外[3] 。此外,肝硬化患者常常因肝功能障碍导致血清胆汁酸浓度增加,而 HSA可以与游离胆汁酸结合,因此对肝硬化患者补充HSA可以降低其血清游离胆汁酸浓度,改善其临床症状[4-5] 。
l 细菌毒素与抗菌药物
HSA可与多种细菌产物结合,如革兰阴性菌的脂多糖和革兰阳性菌的其他成分,包括脂壁酸和肽聚糖[6]。在内毒素血症模型动物中,HSA可显著改善脂多糖引起的血管舒张和收缩能力异常[7]。同时部分抗菌药物药效发挥依赖于HSA与药物结合,发挥增加药物可溶性、降低药物毒性、将药物运输至特定组织和器官等作用[8]。
低白蛋白血症可导致蛋白结合率高的抗菌药物的表观分布容积和清除率(CL)增加,从而使血清有效药物浓度降低[9]。有研究通过模拟血清药物浓度和游离药物浓度,探讨体外条件下HSA对酮康唑和伊曲康唑的抗菌活性的影响,其结果表明与 4%的HSA联用可以提高伊曲康唑的抗真菌活性[10]。
二、炎症反应的调控作用
l 抗氧化应激
HSA分子中的半胱氨酸34(Cys34)上的巯基占血液中所有巯基的80%,是血管内最重要的抗氧化基团。HSA通过半胱氨酸(Cys)基团来清除自由基:健康状态下,当HSA中的Cys34未与其他物质结合而处于游离状态时,Cys34基团主要为巯基态,即还原态,其抗氧化能力强;当HSA中的Cys34基团主要为两种非巯基态即氧化态时,其抗氧化能力弱[12]。
氧化应激是危重症患者病情进展的关键病理基础[13]。在脓毒症和肝功能衰竭状态下处于非巯基态的HSA比例明显升高,此时外源性补充巯基态HSA可以增强危重症患者的内源性抗氧化保护,具有积极意义[14-17]。
l 减轻炎症损伤
炎症损伤时,炎症因子和生长因子诱导毛细血管通透性增加,血管生成增加,细胞和血浆中的白蛋白进入伤口,促进组织生长,肌肉、肝、肾等组织中的白蛋白均以更高的速率进入间质,所以危重患者的炎症损伤会导致低白蛋白血症。
研究显示白蛋白能够下调TNF-α、IL-1及IL-6、CRP、MMP-8的表达通过减少抑制性转运,从而发挥其抑制炎症因子、阻断“炎症风暴”的作用。此外,白蛋白与由EGFR、ERK1和ERK2表达调控的各种组织蛋白的转录密切相关,能够通过上调激活NF-κB途径[21],从而减轻炎症损伤[22-23]。
l 免疫修复作用
在脓毒症发病过程中,HSA既可以通过广谱的抗原结合作用调理及中和微生物、毒素等,抑制炎症,修复机体对感染的过度炎症性免疫反应,也可通过减少免疫细胞的细胞凋亡,解除FCγ受体封锁,缓解免疫抑制[25]。
同时,研究还发现HSA能够增强抗原递呈细胞(antigenpresentingcells,APC)的免疫激活,在两种APC培养基中加入卵白蛋白作为外来抗原,可以诱导APC合成和分泌IL-2。而在培养基中加入HSA则能显著增强这种免疫应答[26]。
三、维护血管内皮功能
血管内皮具有维持血管稳态,调节血管张力、血栓形成、纤维蛋白形成和维护血管壁屏障完整性的功能。HSA调节炎症、减少氧化损伤和干预中性粒细胞粘附的能力可能会影响内皮功能[28-29]。
内皮细胞表面被一种带负电荷的类似网状结构的由糖蛋白、蛋白多糖和可溶性生物大分子成分组成的糖萼所覆盖,糖萼的脱落改变了毛细血管腔和被糖萼层保护的富含蛋白质区域之间的胶体渗透梯度,导致毛细血管泄漏增加,血小板和中性粒细胞的黏附增加[30]。
HSA能与糖萼结合,增强糖萼维持内皮细胞的稳定性,减少白细胞和血小板对内皮的黏附[31-32],同时通过结合内皮细胞上的糖萼后参与小分子物质的转运和抗氧化以此来维持内皮细胞正常的功能[33-34]。
四、抗凝血作用
HSA的复杂结构决定了其能够结合和携带多种物质,其中白蛋白分子结合NO后硝基化的HSA(HSA-NO)具有扩张血管和抑制血小板聚集的潜在临床作用,对血细胞和血小板有良好的保护功能[6]。
HSA具有与肝素有类似的抗凝血活性,两者空间结构相似,且均带有大量的负电荷,肝素属于一类糖胺聚糖,其硫酸基团带负电荷,与带正电荷的抗凝血酶III结合,进而发挥抗凝作用。HSA同样带负电荷,作用机制可能与肝素相似,肝素和HSA都可以减少组蛋白引起的血小板聚集,并可减轻因血小板激活而导致的组织损伤[36-37]。在血液透析时,使用HSA可以降低患者对于抗凝剂的需要量[38-39]。
五、调节酸碱平衡
由于表面的离子化侧链如组氨酸咪唑残基结构的存在,HSA带净电荷,其等电位点pH值约为5.67[42]。因此在血浆中HSA带负电荷,赋予了其作为缓冲剂维持体内酸碱平衡的功能,尤其是由于呼吸循环障碍、严重感染及创伤、温度变化和代谢改变等因素导致的酸中毒具有良好的缓冲作用[42]。
低蛋白血症患者的阴离子间隙下降(血清白蛋白水平每下降10g/L,阴离子间隙参考值下降2mmol/L),其缓冲对抗内环境酸碱紊乱的能力同样下降,我们在临床评估与治疗合并低白蛋白血症的危重患者时应加以重视。
小结
综上所述,HSA是一种具有多种生物学性能和作用的多功能蛋白。其在治疗危重患者中的应用不应仅仅局限于一种复苏胶体液和低蛋白血症的纠正,更应该考虑发挥其多项生物学功能。
当然,确立HSA的“治疗药物”属性依然任重道远,尚有许多疑问待解答:HSA非胶体作用疗效的前瞻性临床试验还有待丰富,仍需大量临床数据来解决使用HSA治疗疾病的获益与风险和成本的争议,明确其最佳给药剂量和给药时间及其对远期预后的影响,确定哪些患者将从长期给药中获益最多等等。这些均有待于临床医师和科研工作者的深入探索。