

时间:2022-08-28 09:01:28
武田医学部和医学界合作,有幸邀请到复旦大学附属华山医院感染科邵凌云教授,对EASL-ILC 2022大会上关于白蛋白非胶体功能和有效白蛋白浓度概念等内容作进一步解读。
白蛋白广泛应用在肝硬化患者并发症的治疗中,其非胶体功能带来的获益受到越来越多学者的重视[1,2]。最近召开的2022 EASL(European Association for the Study of the Liver,欧洲肝脏研究协会)大会上,多位专家分享了关于人血白蛋白非胶体功能对肝硬化治疗效果的最新进展。Mireia Casulleras教授介绍了关于人血白蛋白对急性失代偿肝硬化患者血脂谱影响的临床研究;Raquel Horrillo教授介绍了一项人血白蛋白治疗提高肝硬化腹水大鼠体内白蛋白的结合功能与抗炎症功能的研究。本文结合近年来关于人血白蛋白非胶体功能的相关研究,探讨其对失代偿期肝硬化患者的潜在作用以及有效白蛋白浓度这一新概念。
人血白蛋白改善急性失代偿期(AD)
肝硬化患者的血脂谱,促进炎症介质分解
传统上认为,脂质是细胞膜的组成成分,细胞内的储能物质;现在,脂质还被认为是一个强效的信号分子,参与多种细胞反应的调节,包括参与全身炎症的调节[3]。来源于二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的脂质介质包括消退素、保护素、脂氧素,如ω-3-PUFA、15-HETE和17-HDHA。这些脂质介质具有抗炎和促进炎症消退的作用。前列腺素(PG)在体内由花生四烯酸合成,其中PGE2,PGD2和PGF2α属于炎症介质,有助于促进白细胞进入组织内吞噬和中和外源性病原体[4,5](图1)。而全身炎症是AD肝硬化患者的特征之一。白蛋白对脂质[特别是脂肪酸(FA)]具有高亲和力,脂质分子通过与白蛋白结合,实现在人体内的运输[5]。然而,目前尚不清楚人血白蛋白如何影响AD肝硬化患者的血脂谱。
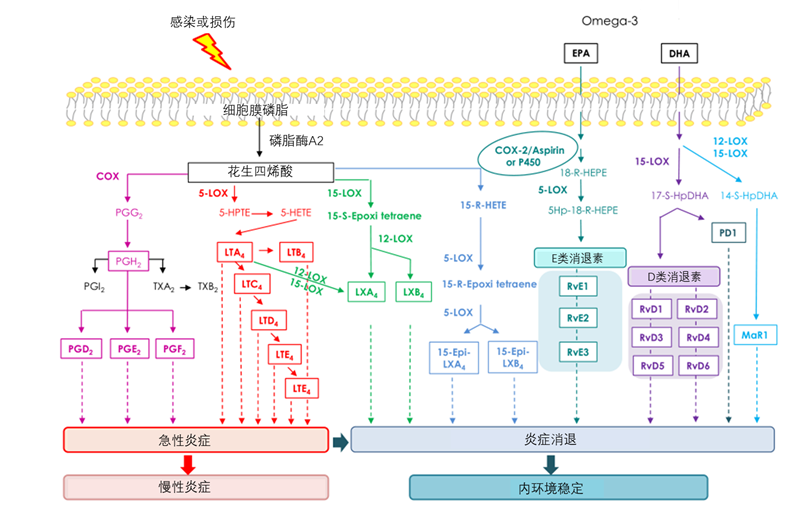
图1:脂质介质的生物合成路径及作用机制[4]
在2022年EASL大会上,来自西班牙的Mireia Casulleras教授介绍了人血白蛋白对AD肝硬化患者血脂谱影响的最新研究[6]。该研究对18名AD肝硬化患者和10名健康受试者的白细胞培养液、血浆、富白蛋白血浆和乏白蛋白血浆进行质谱分析,测定其中的脂质和脂质介质。对41名入组另一项人血白蛋白研究的AD肝硬化患者也进行了相关的脂质介质检测。
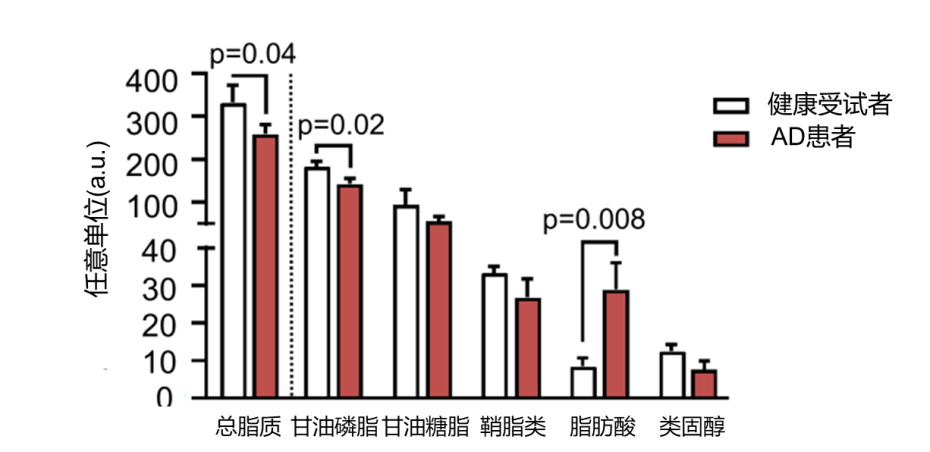
图2:健康受试者和AD患者的血浆血脂谱
结果显示:与健康受试者相比,AD肝硬化患者血浆中的所有脂质,除了FA,均受到广泛抑制(图2)。AD肝硬化患者富白蛋白血浆中的脂质谱以二十二碳六烯酸(DHA)(ω-3-PUFA)、促炎症消退脂质介质15-羟基二十碳四烯酸(15-HETE)和17-羟基多沙六烯酸(17-HDHA)的含量降低为主。同时,AD肝硬化患者的白蛋白在前列腺素(PGs)(PGE2,PGD2和PGF2α)中几近耗尽,提示PG这类炎症介质存在降解失调,使其在循环中的浓度有所升高。
使用外源性人血白蛋白孵育白细胞后,PG的产生减少,同时白蛋白诱导15-脂氧合酶的表达,以及15-HETE和17-HDHA的释放。接受人血白蛋白治疗的AD患者,其体内的PGE2和PGD2水平更低,且人血白蛋白治疗后15-HETE水平较基线有所升高(图3)。
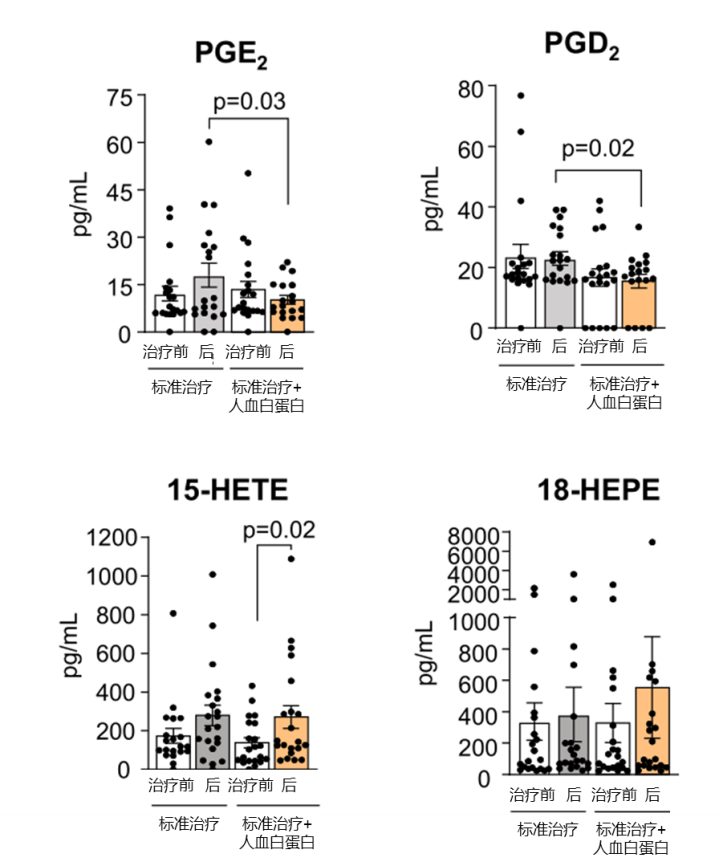
图3:人血白蛋白治疗对AD患者体内血脂介质的作用
该研究结果表明,AD肝硬化患者体内的血液和白蛋白脂质谱都发生严重的紊乱,给予外源性人血白蛋白可能将白细胞的生物合成从促炎症导向转为促分解血脂介质导向。
人血白蛋白
对肝硬化腹水的缓解及抗炎作用
人血白蛋白已被常规应用于肝硬化合并腹水、自发性细菌性腹膜炎、肝肾综合征等患者。除了维持胶体渗透压之外,白蛋白还具有其它的生理功能,例如结合转运、抗氧化和抗炎症等作用[1]。然而,人血白蛋白在肝硬化治疗中的作用机制仍在研究中。
在2022年EASL大会上,来自西班牙的Raquel Horrillo教授介绍一项评估人血白蛋白对肝硬化腹水大鼠的治疗作用的研究[7]。评估指标包括白蛋白结合能力、炎症生物标志物以及转录组学分析。将雄性Wistar大鼠长期暴露于四氯化碳以诱导发生肝硬化。发生肝硬化腹水两周后,大鼠被随机分配在第1天和第3天接受静脉人血白蛋白1.5g/kg(n=20)或安慰剂(0.9%生理盐水;n=16)。
结果发现,与安慰剂组相比,人血白蛋白组的总蛋白和白蛋白水平均显著升高(人血白蛋白组:32[27-34]g/L,安慰剂组22[18-26]g/L,P<0.0001)。血清白蛋白水平升高的同时,白蛋白在肝脏中的表达也趋近于正常水平,提示人血白蛋白具有改善肝功能的作用。人血白蛋白组的白蛋白结合能力(ABiC)也显著高于对照组(49.2[43.3–55.8]%vs 35.7[33.3–43.4]%;P<0.01)(图4)。
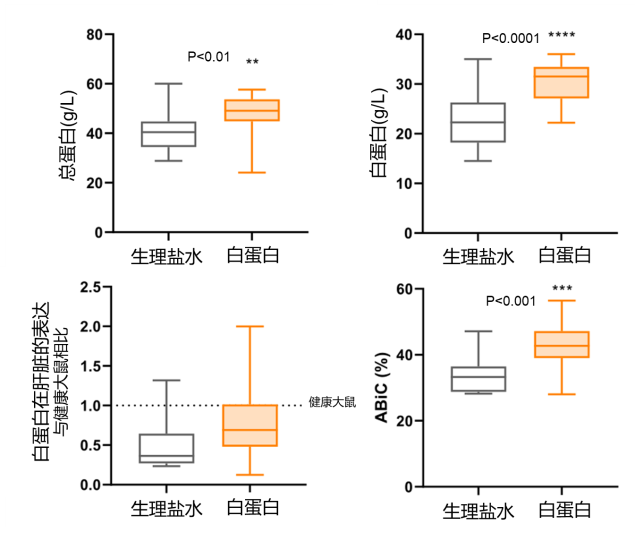
图4:人血白蛋白治疗对总蛋白水平、白蛋白水平、肝脏中白蛋白的表达以及ABiC的作用
在给药72小时后,人血白蛋白组的腹水量显著低于安慰剂组(2.0[2.0–3.0]mL vs 13.5[6.5–25.0]mL;P<0.01)。同时,人血白蛋白组的血清促炎细胞因子IL-2(P<0.01)、IL-18(P<0.01)和TNF-α(P<0.05)均显著低于安慰剂组。此外,在人血白蛋白治疗的大鼠中进行的转录组学分析显示,大鼠肝脏中白蛋白的基因表达增加,而由肝硬化诱导的,在肝、心和肾中发生的与TLR(Toll-Like Receptors)信号通路相关的转录组学变化减弱。
上述研究发现提示,人血白蛋白输注可提高白蛋白的结合功能,从而改善腹水、减轻全身炎症。这些在动物模型中得到的结果与人血白蛋白改善肝病并发症的作用一致。
“有效白蛋白浓度”新概念的提出
肝硬化患者体内的白蛋白不仅在数量上有所减少,常合并低白蛋白血症,在白蛋白的质量上同样存在问题。近年来肝病界提出了“有效白蛋白浓度”这个概念[8],即保持正常生理功能主要是非胶体功能的那部分白蛋白浓度,在一些疾病状态下,有效白蛋白浓度明显低于总白蛋白浓度。
长期应用人血白蛋白可有效
提高肝硬化患者的有效白蛋白浓度
Maurizio Baldassarre教授在2020年EASL大会上,发表了对ANSWER研究的一项补充分析结果[9]。纳入ANSWER研究中有基线和治疗6到8个月时的血浆样本的患者,评估白蛋白的结构异构性(有效白蛋白浓度定义为具有完整分子结构的血清白蛋白的量)。结果发现,长期应用人血白蛋白可显著提高患者的血清白蛋白浓度(从3.1[2.8–3.5]升高到4.1[3.8–4.4]g/dL,P<0.001),以及有效白蛋白浓度(从0.77[0.55–1.05]升高到0.93[0.65–1.26]g/dL,P=0.015)。
Raquel Horrillo教授在2020年的EASL大会上发表了另一项关于长期应用20%的人血白蛋白改善失代偿期肝硬化患者白蛋白结合功能的研究[2]。评估了高剂量(1.5g/kg,每周一次)和低剂量(1g/kg,每2周一次)的人血白蛋白治疗12周,长期输注人血白蛋白对患者的白蛋白结合功能的影响。结果发现,失代偿期肝硬化患者体内的白蛋白的结合功能较差,白蛋白的转运功能减弱,长期的人血白蛋白输注不仅使白蛋白浓度恢复到正常水平,且白蛋白结合转运功能恢复到正常水平;同时改善循环功能障碍(用药后血浆肾素活性峰值>基线值的100%并高于10ng/mL·h的患者比例:高剂量组高于低剂量组12.5%,P=0.04)和肝功能障碍(AST:高剂量组34U/L vs低剂量组53U/L,P=0.02)[10]。
【总结】随着研究的逐步深入,人们发现人血白蛋白具有多种非胶体功能。这些非胶体功能在人血白蛋白用于肝硬化合并腹水、自发性细菌性腹膜炎、肝肾综合征等并发症的治疗中发挥着重要的作用[1]。有效白蛋白浓度这一概念提示,肝硬化患者体内的人血白蛋白不仅在数量上有所减少,质量上也发生了改变[8]。长期应用人血白蛋白可有效提高肝硬化腹水患者的有效白蛋白浓度,可能是这些患者从人血白蛋白治疗中获益的重要原因。
参考文献:
[1]Lejia Sun,et al.Impaired albumin function:a novel potential indicator for liver function damage?,Annals of Medicine,2019;51:7-8,333-344
[2]Raquel Horrillo,et al.Long-term 20%albumin administration normalizes the plasma albumin binding capacity in patients with decompensated cirrhosis.Journal of Hepatology.2020;73:S653–S915.
[3]Zhang C,Wang K,Yang L,et al.Lipid metabolism in inflammation-related diseases.Analyst.2018;143(19):4526-4536.
[4]Talero E,García-Mauriño S,Ávila-Román J,Rodríguez-Luna A,Alcaide A,Motilva V.Bioactive Compounds Isolated from Microalgae in Chronic Inflammation and Cancer.Mar Drugs.2015;13(10):6152-6209.
[5]Serhan CN.Pro-resolving lipid mediators are leads for resolution physiology.Nature.2014;510(7503):92-101.
[6]Mireia Casulleras,et al.Patients with acutely decompensated cirrhos is present a distorted blood lipid landscape that affects the ability of albumin to promote inlammation resolution.Journal of Hepatology.2022;77(S1):S665–S939.
[7]Raquel Horrillo,et al.Ascites reduction and anti-inflammatory effects after albumin infusion for the management of cirrhosis:evidence from an animal model.Journal of Hepatology.2022;77(S1):S665–S939.
[8]Carvalho JR,Verdelho Machado M.New Insights About Albumin and Liver Disease.Ann Hepatol.2018;17(4):547-560.
[9]Maurizio Baldassarre,et al.Effective albumin concentration and albumin function improve after long-term albumin treatment in patients with decompensated cirrhosis.Journal of Hepatology 2020;73:S123–S400.
[10]Fernández J,Clària J,Amorós A,et al.Effects of Albumin Treatment on Systemic and Portal Hemodynamics and Systemic Inflammation in Patients With Decompensated Cirrhosis.Gastroenterology.2019;157(1):149-162.